3o. A, Química, 1-5 marzo
Esc. Sec. Vesp. Luis
Donaldo Colosio Murrieta.
Clave 21EES0277O
Actividades para los
alumnos durante la Fase Aprende en casa III
Nombre del docente: Graciela Rojas Yáñez.
Correo electrónico: secluis.2020@gmail.com
Fecha: del 1 al 5 de marzoo 2021
Tema: “Enlace químico”.
Aprendizaje esperado: Explica las
características de los enlaces químicos a partir del modelo de compartición
(covalente) y de transferencia de electrones (iónico).
Desarrollo del tema: Realiza la siguiente lectura, escribe en tu libreta lo
más importante.
En temas anteriores, estudiamos el
enlace químico, ¿lo recuerdas?
Enlace Químico
El término enlace químico es utilizado para referirse a
la unión que existe entre dos átomos (los cuales pueden ser
iguales o diferentes) con el fin de formar una molécula.
Los átomos están compuestos por un núcleo atómico y a la vez están
rodeados por electrones (los cuales tienen carga eléctrica negativa). En un
enlace químico existe la participación entre los electrones que componen a los
átomos que se están entrelazando, debido a que es a través de ellos que los
enlaces se unan, en términos químicos se dice que es una transferencia de
electrones entre átomos el fenómeno que ocurre en un enlace químico.
Solo los gases nobles y los metales en estado de vapor están presentes naturalmente como átomos aislados, es decir, átomos solos, que no se unen para crear una molécula, por ello se puede afirmar que la mayoría de los elementos que existen son formados por enlaces químicos, los cuales se forman con el fin de alcanzar la estabilidad química. Los enlaces se forman como consecuencia del movimiento que existe entre los electrones de valencia de un átomo, que son los electrones que se encuentran en la capa más externa, es decir, los del último nivel energético, en la mayoría de los casos el objetivo es tener ocho electrones en esta última nube para así poder ser estable (que para ellos se traduce en parecerse lo más posible al gas noble más cercano, tratando de copiar su estructura).


Tarea o respuestas: Escribe un resumen del texto anterior en tu libreta.
Responde las
siguientes preguntas:
1.- ¿Qué son los
electrones de valencia?
2.- ¿Qué
científico determinó que los átomos al enlazarse deberían tener un total de 8
electrones en su último nivel de energía?
3.-¿Cuál es la principal diferencia entre un enlace
covalente y un enlace iónico?
4.- ¿Cuál es la importancia del enlace químico?
Al
correo: Envía tu actividad anterior
al correo no olvides escribir tu nombre completo y grado que cursas.
En el Foro: Escribe con tus palabras, la importancia
del enlace químico y explica cada uno de ellos.


Los enlaces químicos son muy importantes porque permiten que los átomos se agrupen en moléculas, permiten que las moléculas se agrupen entre sí, lo que da lugar a que se forman sustancias puras y compuestas. Infinidad de moléculas y estás infinidades forman las sustancias. Estas agrupaciones de átomos implican uniones y por lo tanto la actividad química. La actividad química de los átomos reside en los electrones específicamente en los electrones de valencia, aquellos que están localizados en la última capa o nivel de energía de un átomo. Esto es que, los átomos se unen entre sí por medio de fuerza de atracción, las cuales los atrae y los mantienen unidos a nivel de los electrones de valencia, así un enlace químico es la unión entre átomos y entre moléculas por medio de fuerzas de atracción; o sea, las fuerzas que unen a los átomos entre sí se llaman enlaces.
ResponderBorrarEnlace covalente: la importancia de los enlaces covalentes es que permiten muchas acciones en el laboratorio y en la industria para transformar unas secuencias en otras.
Enlace iónico: permite que los átomos se agrupe en moléculas permite. Permite que las moléculas se agrupen entre sí, lo cual da lugar a que se formen sustancias puras y compuestas.
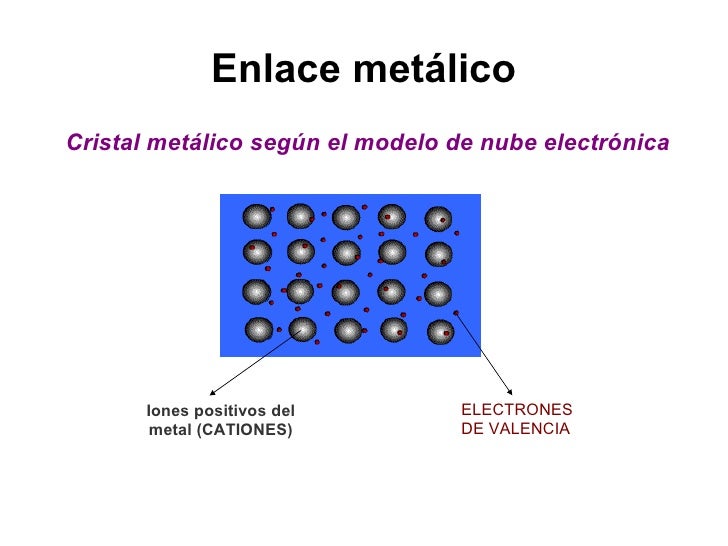
Enlace metálico: Los enlaces metálicos son, como su nombre lo indica, un tipo de unión química que se produce únicamente entre los átomos de un mismo elemento metálico. Gracias a este tipo de enlace los metales logran estructuras moleculares sumamente compactas, sólida y resistentes, dado que los núcleos de sus átomos se juntan a tal extremo, que comparten sus electrones de Valencia.
Camila Gutiérrez Monzalvo
Los enlaces se forman como consecuencia del movimiento que existe entre los electrones de Valencia de un átomo , que son los que se encuentran en la capa más externa , es decir , los del último nivel energético .
ResponderBorrarLos elementos que existen son formados por enlaces químicos , los cuales se forman con el fin de alcanzar la estabilidad química .
En un enlace químico existe la participación entre los electrones que componen a los átomos que se están entrelazando, debido a que es a través de ellos que los enlaces se unan, en términos químicos se dice que es una transferencia de electrones entre átomos el fenómeno que ocurre en un enlace químico.
ResponderBorrarLa importancia del enlace químico y explica cada uno de ellos
ResponderBorrarPERMITEN QUE LOS ÁTOMOS SE AGUPEN EN MOLECULAS PERMITEN QUE LAS MOLÉCULAS PERMITEN QUE LAS MOLÉCULAS SE ENGRUPEN ENTRE ELLAS
Iónico &unión de un metal con un metal con otro
Covalente &unión de dos nometales
Metálico &union entré dos atomos metales
Diego Alberto 3.A
Escribe con tus palabras la importancia del enlace químico y explica cada uno de ellos
ResponderBorrarLos enlaces químicos mantienen unidas a las moléculas y crean
conexiones temporales que son esenciales para la vida los tipos de enlace
químico que se incluyen son covalente iónico así como en laces de
hidrogeno y fuerzas de dispersión
En lace: covalente
La importancia de los covalentes es que permiten muchas reacciones en el laboratorio
y en la industria para transformar unas sustancias en otras
Enlace: iónico
el enlace en el que uno o mas electrones de un átomo es retirado y se une atro átomo
resultados en iones positivos y negativos que se atraen entre si o es el resultado de la
presencia de presencia de atracción electrostática entre los iones de distinto
signo respeto a las valencias de los elementos y el numero de electrones.
Enlace: metálico
El enlace metálico se produce cuando se combinan metales entre si en este caso los
metales entre si en este caso los metales pierden los electrones de
valencia y se forma un nube de electrones entre los núcleos
positivos el enlace metálico se debe a la atracción entre los electrones de
valencia de todos los átomos y los cationes que se forman
Un enlace químico es el proceso químico responsable de las interacciones atractivas entre átomos y moléculas, y que confiere estabilidad a los compuestos químicos diatómicos y poliatómicos. La explicación de tales fuerzas atractivas es un área compleja que está descrita por las leyes de la química cuántica
ResponderBorrarEnlace iónico
ResponderBorrarEl iónico es uno de los tipos de enlace químico más conocidos, siendo el que se forma cuando se unen un metal y un no metal . Un ejemplo típico de enlace iónico lo encontramos en la sal, o en compuestos cristalizados.
Enlaces covalentes
El enlace covalente es un tipo de enlace caracterizado porque los dos átomos a unirse poseen propiedades electronegativas semejantes o incluso idénticas. El enlace covalente supone que ambos átomos comparten entre sí los electrones, sin perder ni ganar en cantidad.
Enlace covalente no polar o puro
Se refiere a un tipo de enlace covalente en que se unen dos elementos con el mismo nivel de electronegatividad y cuya unión no provoca que una de las partes pierda o gane electrones, siendo los átomos del mismo elemento.
Enlace covalente polar
En este tipo de enlace covalente, en realidad el más usual, los átomos que se unen son de distintos elementos. Tampoco en este caso se pierden electrones en ninguno de los átomos, sino que los comparten.
Enlace metálico
En los enlaces metálicos se unen entre sí dos o más átomos de elementos metálicos. Dicha unión se debe no a la atracción entre ambos átomos entre sí, si no entre un catión y los electrones que han quedado libres y ajenos haciendo que sea tal cosa. Los diferentes átomos configuran una red en torno a estos electrones, con patrones que se van repitiendo.
ATTE María del Pilar García Suárez 3A
Enlace covalente. Ocurre entre átomos no metálicos y de cargas electromagnéticas semejantes se unen y comparten algunos pares de electrones de su capa de valencia.
ResponderBorrarEnlace iónico. Consiste en la atracción electrostática entre partículas con cargas eléctricas de signos contrarios llamadas iones.
Enlace metálico
Es un enlace fuerte, que une los núcleos atómicos entre sí, rodeados de sus electrones como en una nube.
La importancia de los enlaces químicos es que esa ellos existen las sustancias
BorrarLos átomos están compuestos por un núcleo atómico y a la vez están rodeados por electrones los cuales tienen carga eléctrica negativa
ResponderBorrarY Solo los gases nobles y los metales en estado de vapor están presentes naturalmente como átomos aislados, es decir, átomos solos, que no se unen para crear una molécula, por ello se puede afirmar que la mayoría de los elementos que existen son formados por enlaces químicos
Jorge bonilla lima
Son gases nobles y metales en estado presentes naturalmente como átomos aislados la mayoría de los casos el objetivo es tener ocho electrones en esta última nube para así poder ser estable
ResponderBorrarLo que yo entendí del tema es que hay tres tipos de Enlaces químicos como: Enlace Covalente, Enlace iónico, Enlace Metálico.
ResponderBorrarY que el enlace químico es utilizado para referirse a la unión que existe entre 2 átomos los cuales no es obligatorio que sean iguales, además que los átomos están compuestos por un núcleo atómico y que a la vez están rodeados por electrones los cuales transportan carga eléctrica negativa.
Atte: Beatriz Sánchez Romero